ما الفرق بين الدورة والمجموعة في الجدول الدوري للعناصر ، يوجد عدد كبير من العناصر الكيميائية ولكل منها مجموعة من الخصائص والصفات التي تميزها عن غيرها، ولتكون دراسة العناصر وخواصها أكثر سهولة تم ترتيبها في الجدول الدوري للعناصر، والذي يتكون من بعض الدورات والمجموعات.
ولتتمكن من فهم الجدول الدوري للعناصر أكثر وطريقة ترتيب العناصر به فإننا من خلال موقع قلمي سوف نقوم بشرح ما الفرق بين الدورة والمجموعة في الجدول الدوري للعناصر
الجدول الدوري
هو جدول يضم كل العناصر الكيميائية التي تم اكتشاها حتى الآن، وعلى الرغم أن الجدول الدوري المستخدم الآن قام بترتيب العناصر به العالم موزلي؛ إلا أنه ما زال يطلق عليه جدول مندليف لأن العالم ديمتري مندليف هو أول من نجح في ترتيب العناصر في جدول.
حيث قام مندليف بترتيب العناصر وفقاً لسلوكها وشهد الجدول بعض التطورات والتغييرات إلى أن قام موزلي بترتيب العناصر به وفقاً للعدد الذري الذي يمثل عدد البروتونات الموجبة في نواة كل عنصر أو عدد الإلكترونات.
ويُعد الجدول الدوري من أهم الاكتشافات العلمية في الكيمياء لأنه ساعد على ترتيب العناصر بشكل منظم وجعل الوصول إلى أي عنصر والتعرف على خواصه الكيميائية من موقعه بالجدول أمر أكثر سهولة.
ويحتوي الجدول الدوري للعناصر على (118) عنصر، بعضها موجود بشكل طبيعي في البيئة وهي بداية من العنصر رقم (1) حتى العنصر رقم (98)، أما باقي العناصر بداية من العنصر رقم (99) وحتى نهاية الجدول فلا يتم الحصول عليها سوى في معامل الكيمياء.
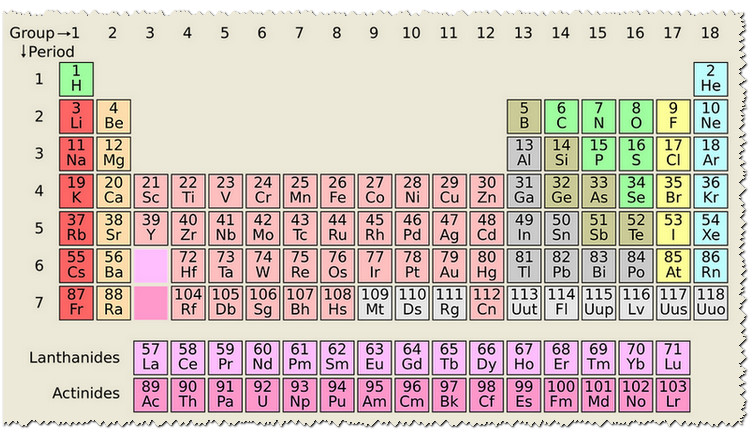
ما الفرق بين الدورة والمجموعة في الجدول الدوري للعناصر
يتكون الجدول الدوري للعناصر في الأساس من الدورات والمجموعات بالإضافة إلى بعض العناصر الانتقالية، حيث يحتوي الجدول على 8 مجموعات رأسية، و7 دورات رأسية، مع العناصر الانتقاليه، ولكل منهم بعض الخواص مثل:
- الدورات: يوجد بالجدول الدوري سبع دورات أفقية يتم ترقيمها بداية من الدورة 1 حتى الدورة 7، والدورة التي يقع بها العنصر تعبر عن السطر الأفقي الموجود به هذا العنصر ويمثل رقم الدورة أيضا عدد المدارات التي تشغلها الإلكترونات الخاصة بكل عنصر، والعناصر الكيميائية التي توجد في دورة واحدة تكون متشابهة الكتلة ولكنها تختلف في الخواص الفيزيائية.
- المجموعات: كما يحتوي الجدول الدوري أيضا على 8 مجموعات رأسية (بدون مجموعات العناصر الانتقالية)، ورقم المجموعة يعبر عن العامود الرأسي الذي يقع به العنصر في الجدول الدوري ويعبر أيضاً عن عدد الإلكترونات الموجودة في المدار الخارجي، والعناصر التي توجد في مجموعة واحدة تكون متشابهة في خواصها الفيزيائية ومختلفة في كتلتها، وبعض المجموعات في الجدول الدوري لها أسماء محددة؛ فالمجموعة الأولى تسمى: (القلويات)، والمجموعة الثانية تسمى: (القلويات الترابية)، والمجموعة السابعة تسمى: (الهالوجينات)، والمجموعة الثامنة تسمى: (الغازات النبيلة).
- العناصر الانتقالية: هي الموجودة في وسط الجدول الدوري وتنقسم إلى: العناصر الانتقالية الرئيسية، والعناصر الانتقالية الداخلية، وتعتبر العناصر الانتقالية هي الأكثر استخداماً عن باقي العناصر.
 قلمي قلمي موسوعة قلمي الشاملة.
قلمي قلمي موسوعة قلمي الشاملة.