قانون هس في الكيمياء ، تعد قوانين الكيمياء من أهم الثوابت العلمية التي تبنى عليها الكثير من النظريات الهامة، ومن خلال موقع قلمي سوف نتعرف على قانون هس في الكيمياء المستخدم لمعرفة مجموع المحتوى الحراري للتفاعلات الكيميائية ومن الذي اكتشفه بالإضافة إلى شرح القانون بشكل مفصل.
قانون هس في الكيمياء
تقوم فكرة قانون هس على أن مقدار التغير الكلي في الطاقة أثناء أي تفاعل كيميائي يكون مساوياً لمجموع التغير في الطاقة في طرفي هذا التفاعل.
اكتشاف قانون هس
تم اكتشاف قانون هس عام 1840 م بواسطة عالم الكيمياء/ جيرمان هنري هس سويدي الجنسية، وهو يعتبر نتيجة لقانون الديناميكا الحرارية الأول ولذلك لا يعد قانون حراري منفصل، ولكن ما جعل قانون هس ذو أهمية هو استخدامه بشكل أساسي لحساب درجة حرارة التفاعلات الكيميائية.
وينص قانون هس على أن الحرارة التي تُمتص أو تتحول خلال أي تفاعل كيميائي يكون لها قيمة ثابتة أثناء كل الخطوات والمراحل التي يمر بها التفاعل.
شرح قانون هس
ساعد قانون هس أو كما يُطلق عليه (قانون حفظ الطاقة) في كتابة معادلة التفاعل الكيميائي بشكل أكثر سهولة، وساعد كذلك على تسهيل معرفة مقدار التغير في الطاقة الكامنة، فالطاقة الكامنة هي الطاقة الداخلية الكلية في أي مركب كيميائي تحت ظروف ضغط معينة، وأي تغير في قيمتها يعتبر تغير في الطاقة الكامنة للمتفاعلات لتكوين نواتج التفاعل.
وعندما تنطلق الطاقة من المركب يأخذ إشارة سالبة لأنه قد فقد جزء من الطاقة، وعندما يمتص الطاقة يأخذ إشارة موجبة.
ومن أهم فرضيات قانون هس أن: الطاقة الداخلية الكامنة الكلية تساوي مجموع الطاقة الداخلية الكامنة الكلية للمواد المتفاعلة وللوسائط التي يتم استخدامها لإتمام التفاعل والحصول على النواتج النهائية لهذا التفاعل، ويمكن معرفة التغير الكلي في مقدار الطاقة الداخلية للمعادلة الموجودة بالصيغة التالية: (أ+ب+ج = أ*ب*ج) من خلال معرفة مقدار التغير في طاقة التفاعل، ويمكن حساب التغير في مقدار الطاقة الداخلية كذلك للمعادلة الموجودة بالصيغة التالية (أ+ب = أب، أب+ج = أ*ب*ج) والمثال التالي يوضح ذلك:
باستخدام قانون هس احسب المحتوى الحراري للمعادلة النهائية التالية:
2CO + 2NO → 2CO2 + N2
التفاعل السابق تم على مرحلتين موضحين من خلال المعادلات التالية:
المعادلة رقم (1): 2CO + O2 → 2CO2 ومقدار التغير الحراري: ΔH = – 566 KJ
المعادلة رقم (2): N2 + O2 → 2NO ومقدار التغير الحراري: ΔH = -180 KJ
المعادلة الأولى بها 2CO في المتفاعلات وكذلك المعادلة النهائية بها 2CO في المتفاعلات وبذلك لن يتم تغيير شيء بالمعادلة رقم (1).
أما في المعادلة الثانية فهي تحتوي على 2NO في النواتج بينما المعادلة النهائية تحتوي عليه في المتفاعلات، وتحتوي على N2 في المتفاعلات بينما المعادلة النهائية تحتوي عليه في النواتج، وبناء على ذلك سوف يتم قلب المعادلة رقم (2) وتغيير إشارة مقدار التغير الحراري من سالب إلى موجب، وتصبح المعادلة كالتالي:
2NO → N2 + O2 ΔH = 180 KJ
وبعد ذلك يتم جمع المعادلة رقم (1) والمعادلة رقم (2) بعد قلبها وشطب المتشابه بينهما وجمع المحتوى الحراري:
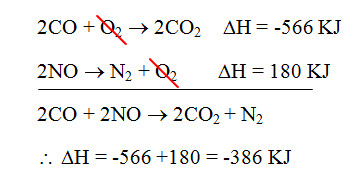
وبذلك يكون مقدار التغير الحراري الكلي للتفاعل الكيميائي هو = – 386 كيلوجول.
اقرأ أيضاً: تسمية المركبات العضوية
 قلمي قلمي موسوعة قلمي الشاملة.
قلمي قلمي موسوعة قلمي الشاملة.